Эффективность и безопасность природной минеральной воды, богатой магнием и сульфатами, для функции кишечника: рандомизированное, плацебо-контролируемое, двойное слепое исследование
Гордана Боте1, Альяз Кох 2, Аннегрет Ауингер1
Статья поступила в редакцию: 25 июня 2015 / Принята: 27 октября 2015
© Авторские права, 2015 г. Статья опубликована в открытом доступе на Springerlink.com
Краткое содержание
Цель. Настоящее рандомизированное, плацебо-контролируемое, двойное слепое исследование было проведено с целью изучить, способствует ли природная минеральная вода с повышенным содержанием сульфата магния и сульфата натрия («Донат магний»/ Donat Mg) улучшению функции кишечника.
Методы. В общей сложности 106 здоровых субъектов с функциональными запорами были распределены методом рандомизации в группы для приема 300 или 500 мл природной минеральной воды в течение 6-недельного курса и группы сравнения, принимавшими воду плацебо. Исследование в группах приема 300 мл было прекращено в связи с результатами, полученными при проведении запланированного промежуточного анализа. Участники исследования записывали в дневнике каждое полное спонтанное опорожнение кишечника, количество спонтанных опорожнений кишечника за неделю в целом, консистенцию стула, желудочно-кишечные симптомы и общее самочувствие. Изменение количества полных спонтанных опорожнений кишечника было определено, как первичный результат исследования.
Результаты. У 75 участников исследования в группах приема 500 мл изменение количества полного спонтанного опорожнения кишечника в неделю после 6 недель, как правило, было выше в группе активного лечения по сравнению с группой плацебо (Т2 = 1,8; значение P=0,036; односторонний критерий). Среднее значение количества полных спонтанных опорожнений кишечника значительно увеличилось во время исследования с существенными различиями между группами исследования, принимая во внимание длительность исследования в целом (F-критерий=4,743; Pвремя × группа = 0,010, двусторонний критерий). При приеме природной минеральной воды, по сравнению с плацебо, консистенция стула при спонтанном опорожнении кишечника значительно улучшилось (P<0,001), субъективно воспринимаемые признаки запоров значительно уменьшились (P=0,005).
Заключение. Ежедневное потребление природной минеральной воды, богатой сульфатом магния и сульфатом натрия, увеличивали частоту опорожнений кишечника и улучшали консистенцию стула у людей с функциональными запорами. Кроме того, улучшилось оценка участниками исследования качества жизни, связанного с состоянием здоровья.
Номер регистрации клинического исследования в базе данных EudraCT: № 2012-005130-11.
Ключевые слова: функция толстого кишечника, частота стула и консистенция, природная минеральная вода, клиническое исследование.
Введение
Запор является не только одним из основных патологических состояний кишечника, влияющих на качество жизни, связанное с состоянием здоровья, но это состояние также включает в себя другие симптомы и проблемы со здоровьем, все это приводит к значительным расходам в здравоохранении [1-3]. Функциональный запор является функциональным желудочно-кишечным расстройством, характеризующимся напряжением мышц во время дефекации, наличием твердого стула или стула в виде отдельных кусков-фрагментов, или ощущением неполного и недостаточно частого опорожнения кишечника без наличия видимых органических или структурных заболеваний [4]. Интегративный обзор одиннадцати исследований, проведенных в Азии, Южной Америки и в европейских странах, показал, что распространенность запоров в общей популяции взрослого населения находится в пределах от 2,6 до 26,9% [5]. В Европе, как сообщается, средний показатель распространенности составляет 17,1% [6].
В принципе, спектр типов стула в общей популяции здорового населения широк, включая твердый, фрагментированный стул в виде отдельных кусков до сосискообразного или змеевидной формы, и до стула кашицеобразного характера, что находится во взаимосвязи со временем прохождения содержимого через кишечник и фекальной массой [7]. Содержание воды в кале, как правило, составляет от 70 до 80%, в то время как у пациентов, страдающих запором, стул более твердый с содержанием воды менее 70% [8]. Консистенция стула часто связана с частотой опорожнения кишечника, которая также значительно различается между отдельными людьми, со средней частотой стула один раз в день, как это сообщается для людей, живущих в западных странах [9].
В целом этиология запора является очень сложной и находится, в основном, под влиянием факторов питания, включая питьевые привычки, а также малоподвижный образ жизни; поэтому изменение образа жизни и питания, как правило, является первой рекомендацией для людей, страдающих запорами [10]. Если изменения образа жизни не приносит желаемого результата, рекомендуется применение слабительных, объемообразующих агентов для улучшения стула, размягчителей стула или других вспомогательных лечебных средств. Однако их применение может вызывать побочные эффекты. Кроме того, согласно данным недавнего опроса в десяти европейских странах, 28% опрошенных были недовольны методами лечения запора, которые они использовали и которые применяются в настоящее время [10].
В перекрестном исследовании, проведенном у японских женщин, было показано, что низкий уровень потребления магния и воды в пище был обратно пропорционален распространенности функциональных запоров. И действительно, соли магния, такие как сульфат магния, известны своим воздействием на осмотические процессы, ускоряющие время прохождения содержимого через кишечник и приводящие к улучшению консистенции стула [11, 12]. В связи с этим предполагается, что природная минеральная вода, богатая солями магния улучшает функцию кишечника. Публикации о контролируемых клинических исследованиях, в которых проводилась оценка влияния богатой минералами воды на функции кишечника, встречались до последнего времени нечасто [13-15].
Целью настоящего рандомизированного, контролируемого, интервенционного исследования было изучить эффект природной минеральной воды, богатой сульфатом магния и сульфатом натрия, на функцию кишечника у здоровых взрослых с функциональными запорами, по сравнению с плацебо.
Методы
Дизайн исследования
Исследование было разработано, как одноцентровое, двойное слепое исследование в параллельных группах, с использованием нескольких доз у лиц с функциональными запорами. Исследование включало в себя плановый адаптивный промежуточный анализ для корректировки размера выборки и оценки различных доз с учетом основной цели исследования. Первая часть клинического исследования была проведена в четырех группах исследования: две группы с использованием суточной дозы 300 мл (активное лечение и плацебо) и две группы с использованием суточной дозы 500 мл (активное лечение и плацебо). После промежуточного анализа исследование в группах с более низким объемом / с более низкой дозой было прекращено, и был откорректирован окончательный размер выборки (для дозы 500 мл). Результаты исследования с использованием более низкой дозы не представлены.
Исследование было одобрено Комитетом по этике (Управление по здравоохранению и социальным вопросам, Берлин, Германия) и соответствующим уполномоченным органом (Федеральный институт лекарственных средств и изделий медицинского назначения, Бонн, Германия). Исследование было проведено в соответствии с Хельсинской декларацией, а также с Фармацевтическим законодательством Германии, Руководящими принципами Международной конференции по гармонизации и нормами Надлежащей клинической практики (ICH-GCP) и нормами Надлежащей клинической практики Германии (GCP-V). Исследование было зарегистрировано в Европейской базе данных клинических исследований (EudraCT) под номером: EudraCT №012-005130-11. До начала исследования участники исследования дали письменное информированное согласие.
Участники исследования
В это исследование, которое проводилось в исследовательском центре в Берлине, Германия, были включены в общей сложности 106 здоровых людей с функциональными запорами. Участники исследования были в возрасте от 18 до 70 лет с функциональными запорами в соответствии с критериями ROME III, имеющими два-четыре опорожнения кишечника в неделю на протяжении предыдущих месяцев [4, 16]. Им было предложено придерживаться прежней диеты и физической активности, и они должны были употреблять, как минимум, 300 мл воды (включая чай). Женщины детородного возраста должны были дать согласие на применение методов контрацепции. Критерии исключения были следующими: острый гастрит и энтерит, склонность к кровотечениям и риск разрыва сосудов в желудочно-кишечном тракте, нарушение перистальтики и секреции в желудочно-кишечном тракте, острые или хронические заболевания желудочно-кишечного тракта, синдром раздраженного кишечника, боли в животе, хирургическая операция в абдоминальной области в анамнезе на протяжении последних 6 месяцев до начала исследования, установленная ранее дисфункция мышц тазовой диафрагмы, склонность к развитию камней в почках, гипер-резорбтивная гиперкальциурия с наличием мочевых камней, инфекция мочевых путей, вызванная кишечной палочкой, почечная недостаточность, острые или хронические заболевания почек и мочевыводящих путей, алкалоз, тяжелые формы заболеваний органов дыхания, сердечно-сосудистая недостаточность, острые воспалительные заболевания, состояния обезвоживания, ограничение в переносимости приема жидкости, острые или хронические неврологические или психические заболевания, потеря веса ≥3 кг в течение последних 3-х месяцев до начала исследования, клинически значимые отклонения лабораторных показателей от нормальных значений, ИМТ > 35 кг/м2, дисфункция щитовидной железы, известная чувствительность к компонентам исследуемого продукта, применение любых препаратов, которые могут оказывать влияние на желудочно-кишечный тракт в течение последних 2-х недель и на протяжении исследования (за исключением резервных препаратов для облегчения симптомов, суппозиториев с бисакодилом, которые можно было бы использовать в случае отсутствия опорожнения кишечника в течение 4-х дней; в течение всего периода исследования было разрешено использование максимум четырех суппозиториев), использование симпатомиметиков и сердечных гликозидов, пищевых добавок с магнием, витаминов или других минералов в ходе исследования, потребление минеральной воды, кроме исследуемого продукта во время исследования; беременность или кормление грудью, злоупотребление лекарственными препаратами, алкоголем или употребление наркотиков, участие в другом клиническом исследовании в течение последних 30 дней до начала исследования, отношение к спонсору или исследователю, или проблемы со следованием протоколу исследования из-за языковых трудностей, или обязательства перед государственными учреждениями власти в силу приказа, изданного либо судебными или административными органами.
Кроме того, испытуемые должны были соответствовать следующим критериям рандомизации в течение вводного периода клинического исследования до начала получения исследуемого продукта (оценивали по записям в дневнике участника исследования): два-четыре опорожнения кишечника в неделю и прием, по крайней мере, 300 мл воды (включая чай.) ежедневно.
Воздействие
На протяжении периода исследования, равного 6-ти неделям, участники исследования принимали назначенную ежедневную дозу природной минеральной воды «Донат магний» (Donat Mg) или воды плацебо, разделенную на два приема: до завтрака и вечером перед ужином. Природную минеральную воду «Донат магний» получают из источника в Рогашка Слатина, Словения. Эта вода обогащается минералами, поступающими в нее при растворении горных пород, находящихся на глубине 280-600 м под землей, что создает концентрацию растворенных минеральных веществ в воде «Донат магний» 13 г/л. И минеральная вода, и вода, использованная в качестве плацебо, производится и разливается в бутылки компанией Дрога Колинска, д.д. (Словения). Основными ингредиентами природной минеральной воды «Донат магний» являются натрий (1600 мг/л), магний (1000 мг/л), кальций (370 мг/л), сульфаты (2000 мг/л) и гидрокарбонаты (7600 мг/л). В качестве плацебо была использована газированная вода, полученная из другого источника в Рогашка Слатина, с низким содержанием минералов (натрия <1 мг/л, магния 30 мг/л, кальция 73 мг/л, сульфатов 17 мг/л, гидрокарбонатов 390 мг/л), содержание CO2 (3,5 г/л) сравнимо с его содержанием в активном продукте, который использовался для исследования.
Клинический этап исследования включал в себя вводный период 10 ± 2 дня и период воздействия 6 недель ± 3 дня. В общей сложности было выполнено пять посещений: скрининговое посещение, посещение на начало исследования (после вводного периода), телефонное посещение (общение с участником по телефону) через 7±3 дня после посещения на начало исследования, контрольное посещение через 21±3 дня после посещения на начало исследования и последнее посещение через 42±3 дня после посещения на начало исследования.
Проверка комплаентности (подверженности участника исследования лечению) была проверена путем подсчета возвращенного неиспользованного исследуемого продукта с учетом оценки срока длительности исследования. Принятое значение степени комплаентности было определено, как 75-125% от должного количества исследуемого продукта и максимум 3 дня отклонения от 6- недельного периода исследования.
Критерий эффективности
Первичным результатом исследования была оценка разницы в изменении количества полных спонтанных опорожнений кишечника у участника исследования (ПСОКу) в неделю между группами плацебо и группами активного лечения на протяжении исследования. Показатель ПСОК был определен, как дефекация с ощущением полного опорожнения кишечника без какого-либо слабительного или клизмы в течение 24 часов после предшествующей дефекации. Кроме того, оценивалось общее количество опорожнений кишечника (ОК), количество спонтанных опорожнений кишечника (СОК, определяемое, как опорожнение кишечника, без какого-либо слабительного или клизмы в течение 24 часов после предшествующей дефекации), а также количество полных опорожнений кишечника (ПОК, которые определялись, как дефекации с ощущением полного опорожнения кишечника). Участников исследования просили записывать консистенцию стула, используя опросник Бристольской шкалы стула/формы кала (Bristol Stool Form Scale, BSFS) [17].
Участники исследования должны были регистрировать в ежедневном дневнике ежедневные опорожнения кишечника, соответствующую форму стула, ощущение полного опорожнения кишечника после дефекации (да/нет), а также использовали ли они ли какие-либо лекарственные средства из резервных препаратов для облегчения симптомов. Кроме того, при каждом посещении после скрининга участники исследования должны были заполнять опросники Шкалы оценки выраженности симптомов со стороны желудочно-кишечного тракта (Gastrointestinal Symptoms Rating Scale, GSRS) [18], Краткую форму опросника по оценке состояния здоровья из 12 пунктов (Short Form 12 Health Survey Questionnaire, SF-12) [19] и краткую форму международного опросника физической активности (IPAQ-SF) [20]. Пищевые и питьевые привычки записывались в дневнике через 3 дня каждую неделю (для вычисления среднего значения ответа на пункты, касающиеся потребления определенных продуктов в день, была использована следующая оценка: ни одного раза = 1, один раз = 2, два или три раза = 3, более трех раз = 4; потребление жидкости регистрировали в мл). Эффективность исследуемых продуктов участники и исследователь оценивали независимо друг от друга в конце исследования с помощью международной шкалы оценки: «очень хорошо», «хорошо», «умеренно» или «плохо».
Биохимические параметры, такие как параметры функции печени и содержание липидов, а также артериальное давление и частоту сердечных сокращений оценивали при проведении скрининга и в конце периода воздействия.
Адаптивный дизайн и статистика
Адаптивный промежуточный анализ был запланирован на момент исследования, когда были получены данные у 50% первоначально запланированного количества участников [21]. Анализ проводился независимым статистиком с использованием выборки популяции пациентов для полного анализа (ППА / Full Analysis Set, FAS). Спонсору исследования были даны соответствующие рекомендации от Независимого комитета по мониторингу данных (НКМД / Independent Data Monitoring Committee, IDMC), в то время как для всех сотрудников, участвующих в проведении исследования, результаты промежуточного анализа оставались неизвестными. При промежуточном и окончательном анализе было запланировано протестировать два набора односторонних подтверждающих гипотез для первичной переменной эффективности дПСОК в каждой из групп приема той или иной дозы (т.е. 300 мл, каждая группа: активный продукт или плацебо; 500 мл, каждая группа: активный продукт или плацебо) (Таблица 1).
Результаты испытаний были проанализированы в соответствии с двухступенчатым адаптивным групповым последовательным дизайном с использованием одного промежуточного анализа с применением критериев досрочного завершения исследования О'Брайен - Флеминга [21]. Каждая гипотеза была проверена (при промежуточном и окончательном анализе) с помощью непараметрического одностороннего U-критерия Манна-Уитни. Для определения общего P-значения (combined p value) для каждого из двух наборов односторонних подтверждающих гипотез был использован обратно-нормальный метод (inverse-normal method) [22].
Таблица 1. Разбиение на подмножества для определения общей ошибки I рода
.png)
Общая вероятность уровня значимости [т.е. частота ошибки с поправкой на эффект множественных сравнений (family-wise error rate, FWER)] была установлена = 0,025 (односторонний). Для контроля общей ошибки I рода = 0,025 (односторонний) была выполнена корректировка уровня значимости. В промежуточном анализе, нулевая гипотеза (H0) не может быть отклонена на любом из уровней доз. Независимый комитет по мониторингу данных (НКМД) дал рекомендацию остановить исследование групп с низким объемом дозы и скорректировать размер выборки для более высокой дозы. Окончательный анализ первичной конечной точки исследования был проведен только для дозы 500 мл с критическим значением критерия значимости T2 для отклонения нулевой гипотезы, равным 1,977. Параметры вторичного критерия эффективности были протестированы в поисковом значении с использованием непараметрических методов U-критерия Манна-Уитни, критерия Уилкоксона и критерия хи-квадрат. Изменения клинических параметров на протяжении времени исследования были проанализированы с помощью поискового анализа ANOVA. Анализ проводили с использованием популяции пациентов для полного анализа и, в дополнение к этому, с использованием анализа VCAS популяции (valid case analysis set / выборка для анализа достоверных случаев), по крайней мере, для первичного результата.
Оценка размера выборки
Расчет оценки размера выборки для промежуточного анализа был основан на предположении о величине эффекта 0,7 для более низкой дозы и 1,0 для более высокой дозы. Повторная оценка размера выборки для продолжения исследования более высокой дозы была рассчитана на основе целевой вероятности получения статистической достоверности в конце исследования, используя метод, предложенный Чангом [23]. При промежуточном анализе учитывали предварительные оценки, наблюдаемое различие в результатах применения активного продукта и плацебо и стандартное отклонение. Вероятность получения статистической достоверности в конце исследования была установлена на уровне 80%. Критическое значение величины α2 для окончательного анализа было установлено на уровне 0,0240.
Результаты
Набор участников исследования
Из 132 человек, оцениваемых на пригодность для включения в исследование, были рандомизированы 106 человек (рис.1.): 30 из них были распределены в группу приема 300 мл, которая была закрыта после завершения промежуточного анализа (данные не представлены). Из 76 человек, распределенных в группы приема 500 мл, 75 были включены в популяцию пациентов для полного анализа (у одного участника не было никаких данных, кроме данных, полученных на начало исследования).
Характеристика участников на момент начала исследования
Из 75 человек в группах приема 500 мл было 63 женщины и 12 мужчин с функциональными запорами в соответствии с критериями ROME III (таблица 2). Различий между участниками групп разного воздействия по исходным характеристикам, включая пищевые и питьевые привычки и физическую активность, не было.
Опорожнение кишечника
Все случаи опорожнения кишечника, включенные в анализ, были спонтанными; следовательно, результаты, приведенные для ПСОКу также действительны для оценки ПОК, и для оценки СОКу, и, соответственно, для оценки ОК. Изменение количества полных спонтанных опорожнений кишечника в неделю после 6 недель лечения, как правило, было выше в группе приема активного продукта по сравнению с группой плацебо (критерий значимости Т2 = 1,8; общее p-значение = 0,036 с подтверждающим уровнем значимости 0,024, односторонний). Отмечена тенденция между группой активного продукта и группой плацебо в отношении изменений ПСОКу на протяжении периода исследования (F критерий: 2.992; P время × группа = 0,054; таблица 3).
Среднее значение соотношения количества ПСОК к ОК у участника исследования (ПСОКу/ОКу) через 6 недель приема воды, богатой минералами, было почти в два раза выше с статистически значимой разницей между группами исследования с учетом всего времени исследования (F критерий = 4,743; P время × группа = 0,010, таблица 3). После недели 3 и недели 6, соответственно, соотношение количества ПСОКу/ОКу был значительно выше у участников исследования, принимавших воду, богатую минералами, по сравнению с группой плацебо (P= 0,006 и P = 0,001, соответственно).
Аналогичные результаты были показаны при анализе популяции VCAS; каких-либо статистически значимых различий между группами активного продукта и плацебо в отношении изменения ПСОКу в неделю не отмечено (P = 0,154), в то время как в отношении показателя соотношения количества ПСОКу/ОКу группы существенно отличались (P = 0,024).
Консистенция стула
Относительно консистенции стула, по показателю соотношения ПСОКу/ОКу, 78,4% в группе активного продукта и 60,5% в группе плацебо сообщили о том, что стул стал мягче после 6 недель приема, в то время как у 8,1% и 23,7% в соответствующих группах стул стал более жестким по сравнению с исходным уровнем на начало исследования (Pактив. <0,001; Pплацебо = 0,012). После недели 3 и недели 6 стул у участников исследования в группе активного продукта был значительное мягче, чем в группе плацебо (P = 0,001 и P <0,001 соответственно; рис. 2). Консистенция стула по показателю соотношения ПСОКу/ОКу на протяжении всего исследования существенно различалась между группами исследования (F критерий = 12,376; Pвремя × группа <0,001).
Желудочно-кишечные симптомы и общее самочувствие
Желудочно-кишечные симптомы оценивали с помощью Шкалы оценки выраженности симптомов со стороны желудочно-кишечного тракта (GSRS.). На протяжении всего периода исследования в соответствии с увеличением количества опорожнений кишечника и суммой баллов оценки консистенции кала по шкале у участников, принимавших воду, богатую минералами, наблюдалось улучшение симптомов, связанных с запорами (P = 0,005), в то время как по другим группам симптомов и по общей оценке суммы баллов по этой шкале различий между группах исследования не было (таблица 4).
Кроме того, были значительные различия между группой приема воды, богатой минералами, и группой плацебо в отношении изменения суммы баллов по шкале SF-12 (Краткий опросник по оценке состояния здоровья из 12 пунктов) от значений на начало исследования (исходный уровень) до значений на неделю 6 (P = 0,017).
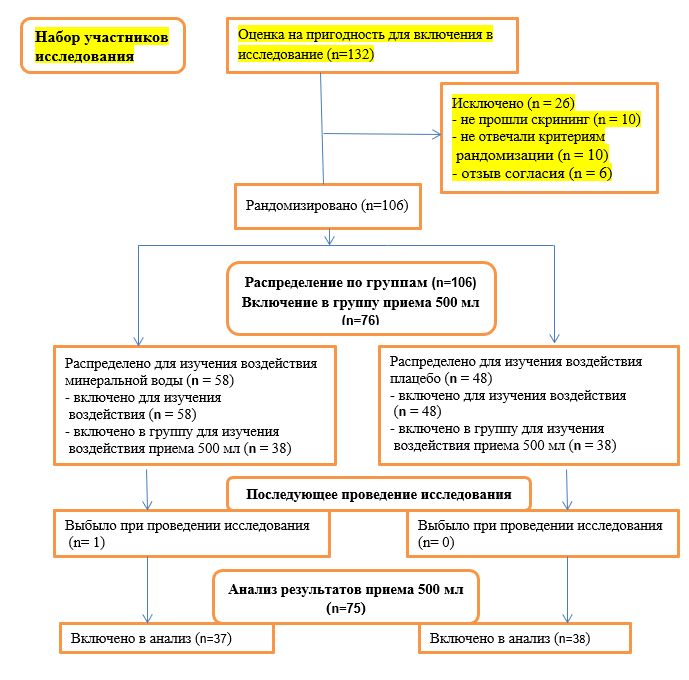
Рис.1 Участники исследования (схема)
Таблица 2. Характеристика участников на начало исследования
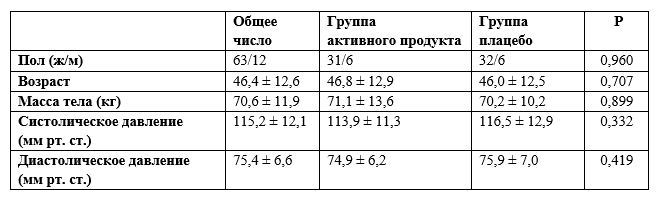
Значение P (U-критерий Манна-Уитни) для определения различий между группами исследования.
Физические характеристики и пищевые привычки
Физическая активность не изменилась ни в одной из исследуемых групп на протяжении периода исследования (P=0,628). В потреблении напитков на протяжении всего исследования не было каких-либо существенных различий между группами исследования. В конце периода воздействия в группе активного продукта участники исследования потребляли немного больше сухофруктов (от 1,04 исходно до 1,15 на неделе 6) и моркови/картофеля (от 1,53 исходно до 1,68 на неделе 6) по сравнению с группой плацебо (сухофрукты: 1,04 исходно до 1,03 на неделе 6, P = 0,04; морковь/картофель 1,68 исходно до 1,60 на неделе 6; P = 0,03).
Оценка эффективности по международным критериям
В конце исследования 94,5% участников в группе приема воды, богатой минералами, по сравнению с 57,9% в группе плацебо, оценили эффективность с использованием международной шкалы критериев, как «очень хорошо» или «хорошо». Аналогично, врачи по шкале эффективности оценили эффективность у 97,2% участников группы приема воды, богатой минералами, как «очень хорошо» или «хорошо», при этом в группе плацебо такую же оценку получили 57,9% участников. Как участника исследования, так и врачи, оценили эффективность воды, богатой минералами, выше, чем воды плацебо (Pchi = 0,001 и Pchi <0,001, соответственно).
Таблица 3. Среднее значение (и SD) количества ПСОКу в неделю и соотношение ПСОКу/ОКу в неделю на протяжении 6-недельного воздействия воды, богатой минералами, или воды плацебо.
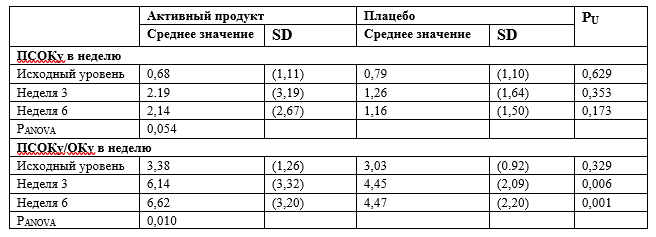
PU - значение P (U-критерий Манна-Уитни) для определения различий между группами исследования.
PANOVA - значение P для анализа RM-ANOVA.
SD – стандартное отклонение.
Оценка безопасности, лабораторные показатели и использование резервных препаратов для облегчения симптомов
В общей сложности отмечено 16 нежелательных явлений, произошедших в течение периода исследования в группах приема 500 мл, без статистически значимых различий между группой приема минеральной воды и группой плацебо (P = 0,571). Двенадцать из них произошли в группе активного продукта, и еще четыре события отмечены в группе плацебо. Один случай в группе активного продукта может быть связан с воздействием. В двух случаях, произошедших в группе активного продукта, причинно-следственная связь нежелательного явления с воздействием, вероятна. Одно из нежелательных явлений в группе активного продукта было классифицировано, как серьезное, но не было связано с воздействием.
Ни один из исследуемых клинических параметров, в том числе печеночные ферменты, триглицериды, холестерин, Х-ЛПВП (холестерин липопротеинов высокой плотности), Х-ЛПНП (холестерин липопротеинов низкой плотности), артериальное давление и частота сердечных сокращений значения, не отличался между группами исследования.
Что касается использования резервных препаратов для облегчения симптомов, в отношении потребления таких препаратов различий между группами не отмечено (P = 0,240).
Статистически значимых различий между группами в отклонении фактического потребления исследуемых препаратов от ожидаемого потребления не было (P>0,1). Показатель степени приверженности лечению с учетом потребления исследуемого продукта составил 102% ± 8,6 в группе активного продукта и 105% ± 9,4 в группе плацебо.
Рис. 2. Консистенции стула СОК/ОК с использованием Бристольской шкалы стула/формы кала (BSFS) (типы по шкале BSFS, медиана, интерквартильный диапазон, диапазон) в течение периода воздействия (серый цвет - группа активного продукта, белый цвет - группа плацебо). Счет по Бристольской шкале стула/формы кала: от 1 (твердые комки) до 7 (водянистый стул). *P - значение P (U-критерий Манна-Уитни) для определения различий между группами исследования.
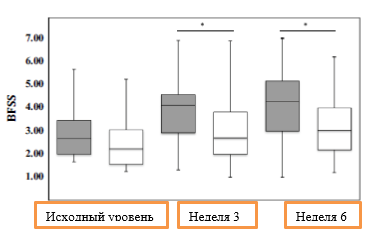
Таблица 4. Среднее значение (и SD) показателя по Шкале оценки выраженности симптомов со стороны желудочно-кишечного (GSRS)
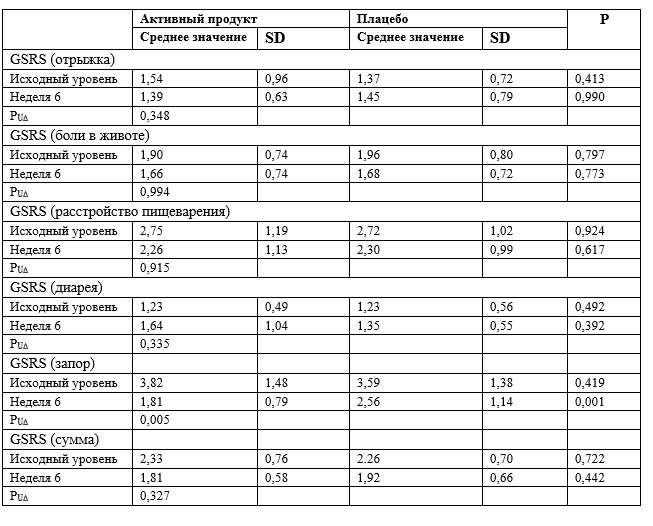
PUΔ - значение P (U-критерий Манна-Уитни) для определения различий между группами исследования в отношении изменения суммы баллов по шкале SSRS между исходным и конечным посещениями.
P - значение P (U-критерий Манна-Уитни) для определения различий между группами исследования.
SD – стандартное отклонение.
Обсуждение
В настоящем рандомизированном, плацебо-контролируемом, двойном слепом, интервенционном исследовании у пациентов с функциональными запорами получены клинические доказательства того, что прием минеральной воды, богатой сульфатом магния и сульфатом натрия в течение 6-недельного курса лечения может дать значительные преимущества для оздоровления пищеварительной системы. Уменьшение симптомов запора, как видно из увеличения количества ПСОКу, общего количества опорожнений кишечника в неделю и появления более мягкого стула по сравнению с группой участников, принимавших воду с низким содержанием минералов, что подтвердило предварительное предположение о стимулирующем воздействии природной воды, богатой минералами, на процесс пищеварения. И действительно, в ходе исследования количество ПСОКу в неделю в группе, принимавших природную воду, богатую минералами, увеличилось более чем в три раза, что сопоставимо с действием подорожника и чернослива, демонстрируя увеличение средней количества ПСОКу в неделю более чем в два раза [24].
Одновременно с улучшением объективных параметров функции кишечника у участников исследования наблюдалось уменьшение запоров с оценкой по шкале GSRS с превышением показателя минимального клинически значимого изменения суммы баллов, равного 0,5 [25] вместе с общим улучшением качества жизни, связанного со здоровьем.
Изменение количества ПСОКу в неделю было выбрано в качестве первичной конечной точки, поскольку это считается наиболее чувствительным параметром оценки общей функции кишечника, и, как информация о полноте опорожнения кишечника [26]. Поскольку адекватного и хорошо контролируемого клинического испытания исследуемого продукта на момент планирования данного исследования не было, для корректировки размера выборки был применен адаптивный дизайн исследования. Это было сделано также для того, чтобы на раннем этапе оценить: необходимо прекратить все клиническое исследование или только его часть, касающуюся групп приема низкой (300 мл) или приема высокой дозы (500 мл), если эффективность по первичной конечной точке отсутствует или уже достигнута при промежуточном анализе. Если рассматривать данные по показателю ПСОКу, то прием 300 мл минеральной воды в день, по-видимому, не дает преимуществ участникам исследования, и поэтому на основании результатов промежуточного анализа дальнейшее исследование этой группы было завершено, в то время как размер выборки групп приема 500 мл был увеличен. Принимая во внимание результаты этого клинического исследования, потребление 500 мл в день минеральной воды «Донат магний», по-видимому, более эффективно, чем прием 300 мл, как для улучшения показателя ПСОКу, так и для опорожнения кишечника в целом, и улучшения консистенции стула.
Поскольку, как предлагается, пищевые привычки и факторы образа жизни влияют на функцию кишечника, была проведена оценка пищевых и питьевых привычек участников исследования и уровня физической активности. В ходе исследования отмечено лишь незначительное увеличение потребления сухофруктов в группе активного продукта по сравнению с группой плацебо. Учитывая полуколичественный характер диетической оценки и наблюдаемые незначительные различий между группами исследования, весьма маловероятно, что это изменение могло оказать влияние на результаты исследования.
Результаты настоящего клинического исследования согласуются с результатами другого недавно опубликованного исследования, в котором сравнивали разные дозы минеральной воды с плацебо. В этом исследовании было показано, что ежедневное употребление 1 л минеральной воды, богатой сульфатом магния (магния 119 мг/л, сульфатов 1530 мг/л), уменьшает запор и улучшает консистенцию стула у женщин с функциональными запорами [13]. Хотя исследовательская группа была ограничена женщинами и первичной конечной точкой был ответ на лечение, который оценивали по компонентам критериев Rome III, при этом о количестве опорожнений кишечника не сообщалось, это исследование подтверждает положительный эффект природной минеральной воды, богатой магнием и сульфатами на функцию кишечника.
В настоящем исследовании изучали воздействие минеральной воды, содержащей 13 г/л растворенных минеральных веществ, среди них был сульфат магния и сульфат натрия. Магния сульфат оказывает осмотическое действие, задерживая воду в просвете кишечника, что приводит к увеличению объема фекальной массы и ее более мягкой консистенции, которая давит на стенки кишечника, провоцируя перистальтику [27, 28]. Исследование, проведенное у здоровых людей, показало, что высокие дозы перорально вводимого сульфата магния приводят к уменьшению времени транзита по кишечнику и модулируют антродуоденальную моторику при лечебном голодании, но не в состоянии после приема пищи [11]. Совсем недавно, в исследованиях in vivo и in vitro было показано, что наряду с изменением осмотического давления, вызванного действием сульфата магния, индуцируется экспрессия осморегуляторных генов [29, 30]. Кроме того, было показано, что экспрессия аквапорин 3 гена, участвующего в регуляции содержания воды в фекальных массах в толстой кишке, была увеличена в толстой кишке у крыс после введения сульфата магния [30]. В другом исследовании у крыс сообщалось о том, что слабительное действие сульфата магния может включать в себя процесс образования оксида азота (NO) посредством стимуляции NO-синтазы [31]. Известно также, что сульфаты увеличивают объем фекальной массы и улучшают консистенцию стула; прием воды, содержащей более 1000 мг сульфата/л, связывали по данным самоотчетов пациентов со слабительным эффектом [32, 33]. Влияние исследуемой минеральной воды на частоту и консистенцию стула, скорее всего, в общей сложности, связано с природным высоким содержанием в ней магния и сульфатов.
Следует отметить некоторые ограничения исследования. В дополнение к действию минеральной воды на запор, оценивали ее влияние на весь желудочно-кишечного тракт и общее качество жизни. Тем не менее, могло бы быть более целесообразным для оценки соответствующих симптомов и качества жизни использовать опросник, разработанный специально для оценки запоров, а не более общие опросники, которые применялись в этом исследовании. При этом, после того, как 50% от первоначально запланированного количества участников были включены в исследование, проведение исследования группы приема более низкой дозы было остановлено на основании рекомендации НКМД (Независимый комитет по мониторингу данных). Тем не менее, возможно, что размер выборки был слишком мал, чтобы сделать однозначный вывод в отношении группы приема 300 мл. Дальнейшие клинические исследования с большим размером выборки могли бы быть полезными для изучения влияния природной воды, богатой минералами. Кроме того, определение других параметров деятельности кишечника, обуславливающих состояние здоровья, таких как фекальная масса, время транзита или потенциальное воздействие на микробиоты, будет способствовать дальнейшему выяснению лежащего в основе механизма действия.
Таким образом, представленное исследование, проведенное у людей, не имеющих других заболеваний, подтверждает положительный эффект ежедневного потребления 500 мл питьевой природной минеральной воды на функции кишечника у лиц с функциональным запором. Кроме того, была доказана безопасность и хорошая переносимость потребления этой специфической минеральной воды. Наблюдаемые результаты подтверждают постулированное предположение, что природную минеральную воду, богатую сульфатом магния и сульфатом натрия, можно рассматривать в качестве первой линии рекомендации для людей с менее частым опорожнением кишечника или твердым стулом для поддержания нормального процесса дефекации. Это, в свою очередь, может помочь уменьшить желудочно-кишечный дискомфорт и развитие заболеваний, часто связанных с запорами. И, наконец, это может улучшить связанное со здоровьем качество жизни и впоследствии снизить экономическое бремя на систему здравоохранения.
Список благодарностей от авторов. Мы хотели бы поблагодарить Нормана Биттерлиха, доктора философии. (Медицин & Сервис, ГмбХ/ Medizin & Service GmbH) и Вернера Баурехта (акромион, ГмбХ/ acromion GmbH) за их существенную поддержку при проведении статистического анализа данных.
Соблюдение этических норм
Конфликт интересов. Исследование финансировалось компанией Дрога Колинска, д.д. (Любляна, Словения). Альяз Кох был нанят для работы компанией Дрога Колинска, д.д. Гордана Боте и Аннегрет Ауингер были наняты для работы контрактной исследовательской организацией. Авторы заявляют об отсутствии каких-либо других конкурирующих интересов относительно этого исследования.
Открытый доступ. Эта статья распространяется в соответствии с условиями лицензии Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), что позволяет ее неограниченное использование, распространение и воспроизведение на любом носителе, при условии, если Вы доверяете автору (авторам) оригинальной статьи и источнику, дайте ссылку на лицензию Creative Commons License и укажите, были ли внесены изменения.
Список литературы
- Dupont C, Campagne A, Constant F (2014) Efficacy and safety of a magnesium sulfate-rich natural mineral water for patients with functional constipation. Clin Gastroenterol Hepatol. doi:10.1016/j.cgh.2013.12.005
- Norton C (2006) Constipation in older patients: effects on quality of life. Br J Nurs. doi:10.12968/bjon.2006.15.4.20542
- Burkitt DP, Walker AR, Painter NS (1972) Effect of dietary fibre on stools and the transit-times, and its role in the causation of disease. Lancet 2(7792):1408–1412
- Sun SX, Dibonaventura M, Purayidathil FW, Wagner JS, Dabbous O, Mody R (2011) Impact of chronic constipation on health-related quality of life, work productivity, and healthcare resource use: an analysis of the National Health and Wellness Survey. Dig Dis Sci. doi:10.1007/s10620-011-1639-5
- Drossman DA (2006) The functional gastrointestinal disorders and the Rome III process. Gastroenterology. doi:10.1053/j.gastro.2006.03.008
- Schmidt FM, Santos VL (2014) Prevalence of constipation in the general adult population: an integrative review. J Wound Ostomy Cont Nurs. doi:10.1097/01.WON.0000438019.21229.b7
- Peppas G, Alexiou VG, Mourtzoukou E, Falagas ME (2008) Epidemiology of constipation in Europe and Oceania: a systematic review. BMC Gastroenterol. doi:10.1186/1471-230X-8-5
- Wyman JB, Heaton KW, Manning AP, Wicks AC (1978) Variability of colonic function in healthy subjects. Gut 19(2):146–150
- Wenzl HH, Fine KD, Schiller LR, Fordtran JS (1995) Determinants of decreased fecal consistency in patients with diarrhea. Gastroenterology 108(6):1729–1738
- Weaver LT (1988) Bowel habit from birth to old age. J Pediatr Gastroenterol Nutr 7(5):637–640
- Muller-Lissner S, Tack J, Feng Y, Schenck F, Specht Gryp R (2013) Levels of satisfaction with current chronic constipation treatment options in Europe—an internet survey. Aliment Pharmacol Ther. doi:10.1111/apt.12124
- Vu MK, Nouwens MA, Biemond I, Lamers CB, Masclee AA (2000) The osmotic laxative magnesium sulphate activates the ileal brake. Aliment Pharmacol Ther 14(5):587–595
- Stewart JJ, Gaginella TS, Olsen WA, Bass P (1975) Inhibitory actions of laxatives on motility and water and electrolyte transport in the gastrointestinal tract. J Pharmacol Exp Ther 192(2):458–4671
- Constant F, Morali A, Arnaud MJ, Delabroise AM, Thirion F, Matisse N, Wagner M, Dohm JP, Vuillemin JL, Gay G (1999) Treatment of idiopathic constipation in infants: comparative and randomized study of twa mineral waters (60 cases). J Pediatr Gastroenterol Nutr 28(5):551
- Gasbarrini G, Candelli M, Graziosetto RG, Coccheri S, Di Iorio F, Nappi G (2006) Evaluation of thermal water in patients with functional dyspepsia and irritable bowel syndrome accompanying constipation. World J Gastroenterol 12(16):2556–2562
- Drossman DA (2006) Rome III: the new criteria. Chin J Dig Dis. doi:10.1111/j.1443-9573.2006.00265.x
- Lewis SJ, Heaton KW (1997) Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol. doi:10.3109/00365529709011203
- Dimenas E, Glise H, Hallerback B, Hernqvist H, Svedlund J, Wiklund I (1995) Well-being and gastrointestinal symptoms among patients referred to endoscopy owing to suspected duodenal ulcer. Scand J Gastroenterol 30(11):1046–1052
- Ware J Jr, Kosinski M, Keller SD (1996) A 12-Item Short-Form Health Survey: construction of scales and preliminary tests of reliability and validity. Med Care 34(3):220–233
- Lee PH, Macfarlane DJ, Lam TH, Stewart SM (2011) Validity of the international physical activity questionnaire short form (IPAQ-SF): a systematic review. Int J Behav Nutr Phys Act. doi:10.1186/1479-5868-8-115
- Chow S-C, Chang M (2012) Adaptive design methods in clinical trials. Chapman & Hall/CRC, New York
- Lehmacher W, Wassmer G (1999) Adaptive sample size calculations in group sequential trials. Biometrics 55(4):1286–1290
- Chang M (2008) Adaptive design theory and implementation using SAS and R. Chapman & Hall/CRC, New York
- Attaluri A, Donahoe R, Valestin J, Brown K, Rao SS (2011) Randomised clinical trial: dried plums (prunes) vs. psyllium for constipation. Aliment Pharmacol Ther. doi:10.1111/j.1365-2036.2011.04594.x
- 25. Talley NJ, Fullerton S, Junghard O, Wiklund I (2001) Quality of life in patients with endoscopy-negative heartburn: reliability and sensitivity of disease-specific instruments. Am J Gastroenterol. doi:10.1111/j.1572-0241.2001.03932.x
- Mueller-Lissner S, Kamm MA, Wald A, Hinkel U, Koehler U, Richter E, Bubeck J (2010) Multicenter, 4-week, double-blind, Eur J Nutr (2017) 56:491–499 4991 randomized, placebo-controlled trial of sodium picosulfate in patients with chronic constipation. Am J Gastroenterol. doi:10.1038/ajg.2010.41
- Donowitz M (1979) Current concepts of laxative action: mechanisms by which laxatives increase stool water. J Clin Gastroenterol 1(1):77–84
- Izzo AA, Gaginella TS, Capasso F (1996) The osmotic and intrinsic mechanisms of the pharmacological laxative action of oral high doses of magnesium sulphate. Importance of the release of digestive polypeptides and nitric oxide. Magnes Res 9(2):133–138
- Ikarashi N, Mochiduki T, Takasaki A, Ushiki T, Baba K, Ishii M, Kudo T, Ito K, Toda T, Ochiai W, Sugiyama K (2011) A mechanism by which the osmotic laxative magnesium sulphate increases the intestinal aquaporin 3 expression in HT-29 cells. Life Sci. doi:10.1016/j.lfs.2010.11.013
- Ikarashi N, Ushiki T, Mochizuki T, Toda T, Kudo T, Baba K, Ishii M, Ito K, Ochiai W, Sugiyama K (2011) Effects of magnesium sulphate administration on aquaporin 3 in rat gastrointestinal tract. Biol Pharm Bull 34(2):238–242
- Izzo AA, Gaginella TS, Mascolo N, Capasso F (1994) Nitric oxide as a mediator of the laxative action of magnesium sulphate. Br J Pharmacol 113(1):228–232
- Moore EW (1952) Physiological effects of the consumption of saline drinking water. In: A progress report to the 16th meeting of the subcommittee on sanitary engineering and environment. Appendix B. National Academy of Sciences, Washington, DC
- Heizer WD, Sandler RS, Seal E Jr, Murray SC, Busby MG, Schliebe BG, Pusek SN (1997) Intestinal effects of sulfate in drinking water on normal human subjects. Dig Dis Sci 42(5):1055–1061



































