Ефективність та безпека природної мінеральної води, багатої магнієм та сульфатами, для функції кишечника: рандомізоване, плацебо-контрольоване, подвійне сліпе дослідження
Гордана Боте, Альяз Кох , Аннегрет Ауінгер
Стаття надійшла до редакції: 25 червня 2015 року / Прийнята: 27 жовтня 2015 року
© Авторські права, 2015 р. Стаття опублікована у відкритому доступі на Springerlink.com
Короткий зміст
Ціль. Справжнє рандомізоване, плацебо-контрольоване, подвійне сліпе дослідження було проведене з метою вивчити, чи сприяє природна мінеральна вода з підвищеним вмістом сульфату магнію та сульфату натрію («Донат магній»/Donat Mg) покращенню функції кишківника.
Методи. Загалом 106 здорових суб'єктів з функціональними закрепами були розподілені методом рандомізації до груп для прийому 300 або 500 мл природної мінеральної води протягом 6-тижневого курсу та групи порівняння, що приймали воду плацебо. Дослідження в групах прийому 300 мл було припинено через результати, отримані при проведенні запланованого проміжного аналізу. Учасники дослідження записували у щоденнику кожне повне спонтанне спорожнення кишечника, кількість спонтанних спорожнень кишечника за тиждень загалом, консистенцію випорожнень, шлунково-кишкові симптоми та загальне самопочуття. Зміна кількості повних спонтанних спорожнень кишечника було визначено як первинний результат дослідження.
Результати. У 75 учасників дослідження у групах прийому 500 мл зміна кількості повного спонтанного спорожнення кишечника на тиждень після 6 тижнів, як правило, було вищим у групі активного лікування порівняно з групою плацебо (Т2 = 1,8; значення P=0,036; односторонній критерій). Середнє значення кількості повних спонтанних спорожнень кишечника значно збільшилося під час дослідження із суттєвими відмінностями між групами дослідження, зважаючи на тривалість дослідження в цілому (F-критерій = 4,743; P × × група = 0,010, двосторонній критерій). При прийомі природної мінеральної води, порівняно з плацебо, консистенція випорожнень при спонтанному спорожненні кишечника значно покращилося (P<0,001), суб'єктивно сприймаються ознаки закрепів значно зменшилися (P=0,005).
Висновок. Щоденне споживання природної мінеральної води, багатої сульфатом магнію та сульфатом натрію, збільшували частоту випорожнень кишечника та покращували консистенцію випорожнень у людей з функціональними закрепами. Крім того, покращилася оцінка учасниками дослідження якості життя, пов'язаного зі станом здоров'я.
Номер реєстрації клінічного дослідження у базі даних EudraCT: № 2012-005130-11.
Ключові слова: функція товстого кишечника, частота випорожнень та консистенція, природна мінеральна вода, клінічне дослідження.
Вступ
Закреп є не тільки одним з основних патологічних станів кишечника, що впливають на якість життя, пов'язане зі станом здоров'я, але цей стан також включає інші симптоми і проблеми зі здоров'ям, все це призводить до значних витрат в охороні здоров'я [1-3]. Функціональний закреп є функціональним шлунково-кишковим розладом, що характеризується напругою м'язів під час дефекації, наявністю твердого випорожнення або випорожнення у вигляді окремих шматків-фрагментів, або відчуттям неповного і недостатньо частого спорожнення кишечника без наявних органічних або структурних захворювань [4].
Інтегративний огляд одинадцяти досліджень, проведених в Азії, Південної Америки та у європейських країнах, показав, що поширеність запорів у загальній популяції дорослого населення знаходиться в межах від 2,6 до 26,9% [5]. У Європі, як повідомляється, середній показник поширеності становить 171% [6].
Загалом, спектр типів випорожнень у загальній популяції здорового населення широкий, включаючи твердий, фрагментований стілець у вигляді окремих шматків до сосископодібної або змієподібної форми, і до стільця кашкоподібного характеру, що перебуває у взаємозв'язку з часом проходження вмісту через кишечник і фекальною масою [7] . Вміст води в калі, як правило, становить від 70 до 80%, у той час як у пацієнтів, які страждають на закреп, стілець твердіший із вмістом води менше 70% [8]. Консистенція випорожнень часто пов'язана з частотою випорожнення кишечника, яка також значно різниться між окремими людьми, із середньою частотою випорожнень один раз на день, як це повідомляється для людей, що живуть у західних країнах [9].
Етіологія закрепу є дуже складною і перебуває, переважно, під впливом чинників харчування, включаючи питні звички, і навіть малорухливий спосіб життя; тому зміна способу життя та харчування, як правило, є першою рекомендацією для людей, які страждають на закреп [10]. Якщо зміни способу життя не приносить бажаного результату, рекомендується застосування проносних, об'ємоутворюючих агентів для поліпшення випорожнень, розм'якшувачів випорожнень або інших допоміжних лікарських засобів. Однак їх застосування може спричинити побічні ефекти. Крім того, згідно з даними недавнього опитування в десяти європейських країнах, 28% опитаних були незадоволені методами лікування запору, які вони використовували та які застосовуються на даний час [10].
У перехресному дослідженні, проведеному у японських жінок, було показано, що низький рівень споживання магнію та води в їжі був обернено пропорційний поширеності функціональних закрепів.
І дійсно, солі магнію, такі як сульфат магнію, відомі своїм впливом на осмотичні процеси, що прискорюють час проходження вмісту через кишечник і призводять до покращення консистенції випорожнень [11,12]. У зв'язку з цим передбачається, що природна мінеральна вода, багата на солі магнію покращує функцію кишечника.
Публікації про контрольовані клінічні дослідження, в яких проводилася оцінка впливу багатої мінералами води на функції кишечника, зустрічалися до останнього часу нечасто [13-15].
Метою справжнього рандомізованого, контрольованого, інтервенційного дослідження було вивчити ефект природної мінеральної води, багатої на сульфат магнію і сульфат натрію, на функцію кишечника у здорових дорослих з функціональними закрепами, порівняно з плацебо.
Методи
Дизайн дослідження
Дослідження було розроблено як одноцентрове, подвійне сліпе дослідження в паралельних групах з використанням декількох доз у осіб з функціональними закрепами. Дослідження включало плановий адаптивний проміжний аналіз для коригування розміру вибірки та оцінки різних доз з урахуванням основної мети дослідження.
Перша частина клінічного дослідження була проведена в чотирьох групах дослідження:
- дві групи з використанням добової дози 300 мл (активне лікування та плацебо)
- дві групи з використанням добової дози 500 мл (активне лікування та плацебо).
Після проміжного аналізу дослідження у групах з нижчим об'ємом/з нижчою дозою було припинено, та було відкориговано остаточний розмір вибірки (для дози 500 мл). Результати дослідження з використанням нижчої дози не представлені.
Дослідження було схвалено Комітетом з етики (Управління з охорони здоров'я та соціальних питань, Берлін, Німеччина) та відповідним уповноваженим органом (Федеральний інститут лікарських засобів та виробів медичного призначення, Бонн, Німеччина). Дослідження було проведено відповідно до Гельсінської декларації, а також з Фармацевтичним законодавством Німеччини, Керівними принципами Міжнародної конференції з гармонізації та нормами Належної клінічної практики (ICH-GCP) та нормами Належної клінічної практики Німеччини (GCP-V).
Дослідження було зареєстроване в Європейській базі даних клінічних досліджень (EudraCT) за номером: EudraCT №012-005130-11.
До початку дослідження учасники дослідження дали письмову поінформовану згоду.
Учасники дослідження
У це дослідження, яке проводилося в дослідному центрі в Берліні, Німеччина, було включено загалом 106 здорових людей з функціональними закрепами.
Учасники дослідження були у віці від 18 до 70 років із функціональними закрепами відповідно до критеріїв ROME III, що мають два-чотири спорожнення кишечника на тиждень протягом попередніх місяців [4, 16].
Їм було запропоновано дотримуватися колишньої дієти та фізичної активності, і вони мали вживати, як мінімум, 300 мл води (включаючи чай). Жінки дітородного віку мали дати згоду застосування методів контрацепції.
Критерії виключення були такими: гострий гастрит та ентерит, схильність до кровотеч та ризик розриву судин у шлунково-кишковому тракті, порушення перистальтики та секреції у шлунково-кишковому тракті, гострі або хронічні захворювання шлунково-кишкового тракту, синдром подразненого кишечника, хірургічна операція в абдомінальній ділянці в анамнезі протягом останніх 6 місяців до початку дослідження, встановлена раніше дисфункція м'язів тазової діафрагми, схильність до розвитку каменів у нирках, гіперрезорбтивна гіперкальціурія з наявністю сечових каменів, інфекція сечових шляхів, спричинена кишковою паличкою. гострі або хронічні захворювання нирок та сечовивідних шляхів, алкалоз, важкі форми захворювань органів дихання, серцево-судинна недостатність, гострі запальні захворювання, стани зневоднення, обмеження в переносимості прийому рідини, гострі або хронічні неврологічні або психічні захворювання, втрата ваги ≥3 кг протягом останніх 3-х місяців до початку дослідження, клінічно значущі відхилення лабораторних показників від нормальних значень, ІМТ > 35 кг/м2, дисфункція щитовидної залози, відома чутливість до компонентів досліджуваного продукту, застосування будь-яких препаратів, які можуть надавати вплив на шлунково-кишковий тракт протягом останніх 2-х тижнів та протягом дослідження (за винятком резервних препаратів для полегшення симптомів, супозиторіїв з бісакодилом, які можна було б використовувати у разі відсутності спорожнення кишечнику протягом 4-х днів; протягом всього періоду дослідження було дозволено використання максимум чотирьох супозиторіїв), використання симпатоміметиків та серцевих глікозидів, харчових добавок з магнієм, вітамінів або інших мінералів у ході дослідження, споживання мінеральної води, крім досліджуваного продукту під час дослідження; вагітність або годування груддю, зловживання лікарськими препаратами, алкоголем або вживання наркотиків; участь в іншому клінічному дослідженні протягом останніх 30 днів до початку дослідження; установами влади в силу наказу, виданого або судовими чи адміністративними органами. Крім того, випробувані повинні були відповідати наступним критеріям рандомізації протягом вступного періоду клінічного дослідження до початку отримання досліджуваного продукту (оцінювали за записами в щоденнику учасника дослідження): два-чотири спорожнення кишечника на тиждень та прийом принаймні 300 мл води (включаючи чай.) щодня.
Вплив
Протягом періоду дослідження, що дорівнює 6-ти тижням, учасники дослідження приймали призначену щоденну дозу природної мінеральної води «Донат магній» (Donat Mg) або води плацебо, розділену на два прийоми: до сніданку та ввечері перед вечерею.
Природну мінеральну воду «Донат магній» одержують із джерела у Рогашка Слатіна, Словенія. Ця вода збагачується мінералами, що надходять до неї під час розчинення гірських порід, що знаходяться на глибині 280-600 м під землею, що створює концентрацію розчинених мінеральних речовин у воді «Донат магній» 13 г/л. І мінеральна вода, і вода, використана як плацебо, виробляється та розливається у пляшки компанією Дрога Колінська, (Словенія).
Основними інгредієнтами природної мінеральної води «Донат магній» є натрій (1600 мг/л), магній (1000 мг/л), кальцій (370 мг/л), сульфати (2000 мг/л) та гідрокарбонати (7600 мг/л).
Як плацебо була використана газована вода, отримана з іншого джерела в Рогашка Слатіна, з низьким вмістом мінералів (натрію <1 мг/л, магнію 30 мг/л, кальцію 73 мг/л, сульфатів 17 мг/л, гідрокарбонатів 390 мг/ л), вміст CO2 (3,5 г/л) порівняно з вмістом в активному продукті, який використовувався для дослідження.
Клінічний етап дослідження включав вступний період 10 ± 2 дні і період впливу 6 тижнів ± 3 дні. Загалом було виконано п'ять відвідувань: скринінгове відвідування, відвідування на початок дослідження (після вступного періоду), телефонне відвідування (спілкування з учасником по телефону) через 7±3 дні після відвідування на початок дослідження, контрольне відвідування через 21±3 дні після відвідування на початок дослідження та останнє відвідування через 42±3 дні після відвідин на початок дослідження.
Перевірку комплаентності (схильності учасника дослідження до лікування) було перевірено шляхом підрахунку поверненого невикористаного досліджуваного продукту з урахуванням оцінки терміну тривалості дослідження. Прийняте значення ступеня комплаентности було визначено, як 75-125% від належної кількості досліджуваного препарату і максимум 3 дні відхилення від 6-тижневого періоду дослідження.
Критерій ефективності
Первинним результатом дослідження була оцінка різниці у зміні кількості повних спонтанних спорожнень кишечника у учасника дослідження (ПССК) на тиждень між групами плацебо та групами активного лікування протягом дослідження.
Показник ПССК був визначений як дефекація з відчуттям повного випорожнення кишечника без будь-якого проносного або клізми протягом 24 годин після попередньої дефекації.
Крім того, оцінювалася загальна кількість випорожнень кишечника (ВК), кількість спонтанних випорожнень кишечника (СВК, що визначається, як випорожнення кишечника, без будь-якого проносного або клізми протягом 24 годин після попередньої дефекації), а також кількість повних випорожнень кишечника (ПВК, які визначалися як дефекації з відчуттям повного спорожнення кишечника).
Учасників дослідження просили записувати консистенцію випорожнень, використовуючи опитувальник Брістольської шкали стільця/форми калу (Bristol Stool Form Scale, BSFS) [17].
Учасники дослідження повинні були реєструвати в щоденнику щоденні спорожнення кишечника, відповідну форму випорожнення, відчуття повного випорожнення кишечника після дефекації (так/ні), а також чи використовували вони будь-які лікарські засоби з резервних препаратів для полегшення симптомів. Крім того, при кожному відвідуванні після скринінгу учасники дослідження мали заповнювати опитувальники Шкали оцінки виразності симптомів з боку шлунково-кишкового тракту (Gastrointestinal Symptoms Rating Scale, GSRS) [18], Коротку форму опитувальника з оцінки стану здоров'я з 12 пунктів (Short Form ) Health Survey Questionnaire, SF-12) [19] та коротку форму міжнародного опитувальника фізичної активності (IPAQ-SF) [20].
Харчові та питні звички записувалися в щоденнику через 3 дні щотижня (для обчислення середнього значення відповіді на пункти, що стосуються споживання певних продуктів на день, було використано таку оцінку: жодного разу = 1, один раз = 2, два чи три рази = 3 більше трьох разів = 4; споживання рідини реєстрували в мл).
Ефективність досліджуваних продуктів учасники та дослідник оцінювали незалежно один від одного наприкінці дослідження за допомогою міжнародної шкали оцінки: «дуже добре», «добре», «помірно» чи «погано».
Біохімічні параметри, такі як параметри функції печінки та вміст ліпідів, а також артеріальний тиск та частоту серцевих скорочень оцінювали при проведенні скринінгу та наприкінці періоду впливу.
Адаптивний дизайн та статистика
Адаптивний проміжний аналіз був запланований на момент дослідження, коли були отримані дані у 50% запланованої кількості учасників [21]. Аналіз проводився незалежним статистиком із використанням вибірки популяції пацієнтів для повного аналізу (ППА/Full Analysis Set, FAS). Спонсору дослідження були надані відповідні рекомендації від Незалежного комітету з моніторингу даних (НКМД/IDMC), в той час як для всіх співробітників, які беруть участь у проведенні дослідження, результати проміжного аналізу залишалися невідомими.
При проміжному та остаточному аналізі було заплановано протестувати два набори односторонніх підтверджуючих гіпотез для первинної змінної ефективності дПСВК у кожній із груп прийому тієї чи іншої дози (тобто 300 мл, кожна група: активний продукт або плацебо; 500 мл, кожна продукт чи плацебо) (Таблиця 1).
Результати випробувань були проаналізовані відповідно до двоступінчастого адаптивного групового послідовного дизайну з використанням одного проміжного аналізу із застосуванням критеріїв дострокового завершення дослідження О'Брайєна - Флемінга [21]. Кожна гіпотеза була перевірена (при проміжному та остаточному аналізі) за допомогою непараметричного одностороннього U-критерію Манна-Уітні. Для визначення загального P-значення (combined p value) для кожного з двох наборів односторонніх гіпотез, що підтверджують, був використаний зворотно-нормальний метод (inverse-normal method) [22].
Таблиця 1. Розбиття на підмножини визначення загальної помилки I роду
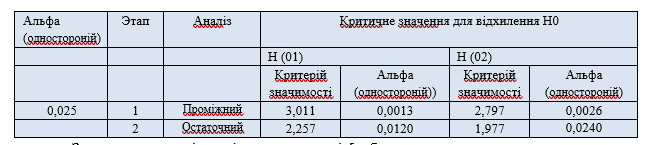
Загальна можливість рівня значимості [тобто. частота помилки з поправкою на ефект множинних порівнянь (family-wise error rate, FWER)] було встановлено = 0,025 (односторонній). Для контролю загальної помилки I роду = 0,025 (односторонній) було виконано коригування рівня значимості. У проміжному аналізі нульова гіпотеза (H0) не може бути відхилена на будь-якому з рівнів доз. Незалежний комітет з моніторингу даних (НКМД) дав рекомендацію зупинити дослідження груп із низьким обсягом дози та скоригувати розмір вибірки для більш високої дози. Остаточний аналіз первинної кінцевої точки дослідження був проведений лише для дози 500 мл з критичним значенням критерію значимості T2 для відхилення нульової гіпотези, що дорівнює 1,977. Параметри вторинного критерію ефективності були протестовані у пошуковому значенні з використанням непараметричних методів U-критерію Манна-Уітні, критерію Вілкоксону та критерію хі-квадрат. Зміни клінічних параметрів протягом часу дослідження проаналізовано за допомогою пошукового аналізу ANOVA. Аналіз проводили з використанням популяції пацієнтів для повного аналізу та, на додаток до цього, з використанням аналізу VCAS популяції (valid case analysis set / вибірка для аналізу достовірних випадків) принаймні для первинного результату.
Оцінка розміру вибірки
Розрахунок оцінки розміру вибірки для проміжного аналізу був заснований на припущенні про величину ефекту 0,7 більш низької дози і 1,0 для більш високої дози. Повторна оцінка розміру вибірки для продовження дослідження вищої дози розрахована на основі цільової ймовірності отримання статистичної достовірності в кінці дослідження, використовуючи метод, запропонований Чангом [23]. При проміжному аналізі враховували попередні оцінки, відмінність в результатах застосування активного продукту і плацебо і стандартне відхилення. Імовірність отримання статистичної достовірності наприкінці дослідження було встановлено лише на рівні 80%. Критичне значення величини α2 для остаточного аналізу встановлено на рівні 0,0240.
Результати
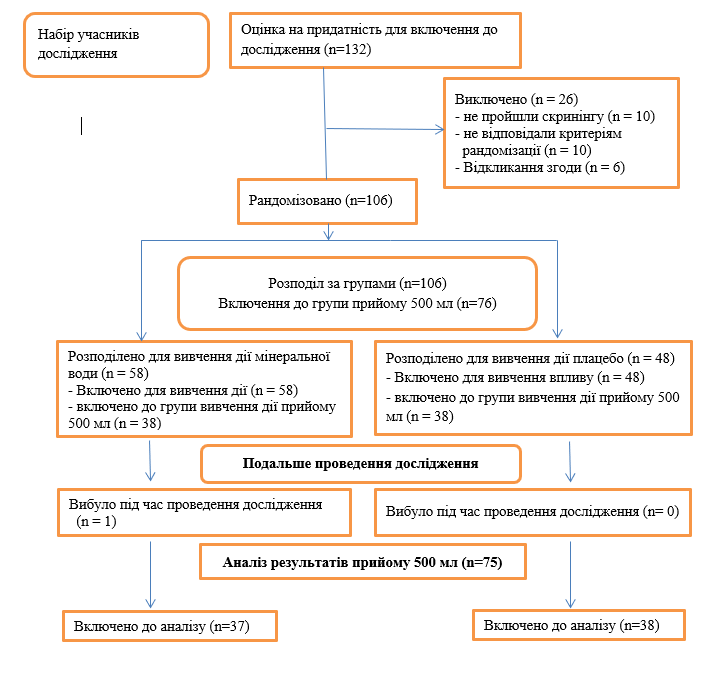
Набір учасників дослідження. З 132 осіб, оцінюваних на придатність для включення до дослідження, було рандомізовано 106 осіб (рис.1.): 30 з них було розподілено до групи прийому 300 мл, яка була закрита після завершення проміжного аналізу (дані не представлені). З 76 осіб, розподілених у групи прийому 500 мл, 75 були включені до популяції пацієнтів для повного аналізу (в одного учасника не було жодних даних, крім даних, отриманих на початок дослідження).
Характеристика учасників на момент початку дослідження. З 75 осіб у групах прийому 500 мл було 63 жінки та 12 чоловіків з функціональними запорами відповідно до критеріїв ROME III (таблиця 2). Відмінностей між учасниками груп різного впливу за вихідними характеристиками, включаючи харчові та питні звички та фізичну активність, не було.
Випорожнення кишечника. Усі випадки спорожнення кишечника, включені до аналізу, були спонтанними; отже, результати, наведені для ПСВК також дійсні для оцінки ПВК, і для оцінки СВК, і, відповідно, для оцінки ВК. Зміна кількості повних спонтанних спорожнень кишечника на тиждень після 6 тижнів лікування, як правило, була вищою в групі прийому активного продукту в порівнянні з групою плацебо (критерій значимості Т2 = 1,8; загальне p-значення = 0,036 з підтверджуючим рівнем значимості 0,024, одне ). Відзначено тенденцію між групою активного продукту та групою плацебо щодо змін ПСВК протягом періоду дослідження (F критерій: 2.992; P час × група = 0,054; таблиця 3).
Середнє значення співвідношення кількості ПСВК до ВК у учасника дослідження (ПСВК/ВК) через 6 тижнів прийому води, багатої мінералами, було майже вдвічі вище зі статистично значущою різницею між групами дослідження з урахуванням всього часу дослідження (F критерій = 4,743; P час × Група = 0,010, таблиця 3). Після тижня 3 та тижня 6, відповідно, співвідношення кількості ПСВКу/ВК було значно вищим у учасників дослідження, які приймали воду, багату мінералами, порівняно з групою плацебо (P = 0,006 і P = 0,001, відповідно).
Аналогічні результати були показані під час аналізу популяції VCAS; будь-яких статистично значущих відмінностей між групами активного продукту та плацебо щодо зміни ПСВК на тиждень не відзначено (P = 0,154), тоді як щодо показника співвідношення кількості ПСВК/ВК групи суттєво відрізнялися (P = 0,024).
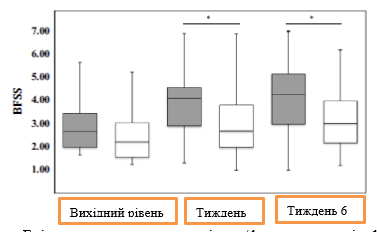
Консистенція стільця. Щодо консистенції випорожнень, за показником співвідношення ПСВК/ВК, 78,4% у групі активного продукту і 60,5% у групі плацебо повідомили про те, що стілець м'якший після 6 тижнів прийому, у той час як у 8,1% і 23,7% у відповідних групах стілець став жорсткішим порівняно з вихідним рівнем на початок дослідження (Pактив. <0,001; Pплацебо = 0,012). Після тижня 3 і тижня 6 стілець в учасників дослідження групи активного продукту був значно м'якше, ніж у групі плацебо (P = 0,001 і P <0,001 відповідно; рис. 2). Консистенція випорожнень за показником співвідношення ПСВКу/ВК протягом усього дослідження суттєво відрізнялася між групами дослідження (F критерій = 12,376; P × група <0,001).
Шлунково-кишкові симптоми та загальне самопочуття. Шлунково-кишкові симптоми оцінювали за допомогою Шкали оцінки симптомів з боку шлунково-кишкового тракту (GSRS.). Протягом усього періоду дослідження відповідно до збільшення кількості спорожнень кишечника та суми балів оцінки консистенції калу за шкалою у учасників, які приймали воду, багату мінералами, спостерігалося покращення симптомів, пов'язаних із запорами (P = 0,005), у той час як за іншими групами симптомів і за загальною оцінкою суми балів за цією шкалою відмінностей між групами дослідження не було (таблиця 4).
Крім того, були значні відмінності між групою прийому води, багатою мінералами, та групою плацебо щодо зміни суми балів за шкалою SF-12 (Короткий опитувальник з оцінки стану здоров'я з 12 пунктів) від значень на початок дослідження (вихідний рівень) до значень на тиждень 6 (P = 0,017).
Мал. 1. Учасники дослідження (схема)
Таблиця 2. Характеристика учасників початку дослідження
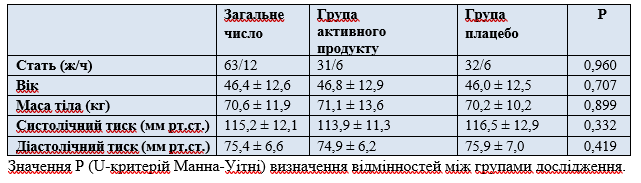
Значення P (U-критерій Манна-Уітні) визначення відмінностей між групами дослідження.
Фізичні характеристики та харчові звички. Фізична активність не змінилася в жодній із досліджуваних груп протягом періоду дослідження (P=0,628). У споживанні напоїв протягом усього дослідження не було якихось суттєвих відмінностей між групами дослідження. Наприкінці періоду впливу в групі активного продукту учасники дослідження споживали трохи більше сухофруктів (від 1,04 до 1,15 на тижні 6) і моркви/картоплі (від 1,53 до 1,68 на тижні 6) в порівнянні з групою плацебо (сухофрукти: 1,04 до 1,03 на тижні 6, P = 0,04; морква/картопля 1,68 до 1,60 на тижні 6; P = 0,03).
Оцінка ефективності за міжнародними критеріями. Наприкінці дослідження 94,5% учасників у групі прийому води, багатої на мінералі, порівняно з 57,9% у групі плацебо, оцінили ефективність з використанням міжнародної шкали критеріїв, як «дуже добре» чи «добре». Аналогічно, лікарі за шкалою ефективності оцінили ефективність у 97,2% учасників групи прийому води, багатої на мінералі, як «дуже добре» або «добре», при цьому в групі плацебо таку ж оцінку отримали 57,9% учасників. Як учасники дослідження, так і лікарі, оцінили ефективність води, багатої мінералами, вищою, ніж води плацебо (Pchi = 0,001 та Pchi <0,001, відповідно).
Таблиця 3. Середнє значення (і SD) кількості ПСВК на тиждень і співвідношення ПСВК/ВК на тиждень протягом 6-ти недельного впливу води, багатої мінералами, або води плацебо.
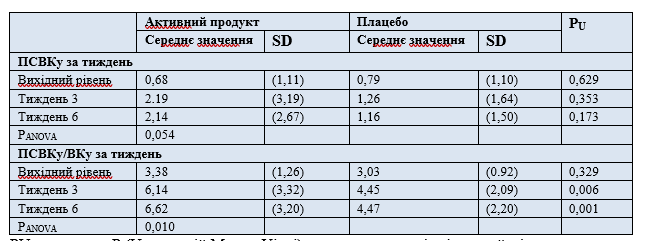
PU – значення P (U-критерій Манна-Уітні) для визначення відмінностей між групами дослідження.
PANOVA – значення P для аналізу RM-ANOVA.
SD – стандартне відхилення.
Оцінка безпеки, лабораторні показники та використання резервних препаратів для полегшення симптомів
Загалом зазначено 16 небажаних явищ, що відбулися протягом періоду дослідження у групах прийому 500 мл, без статистично значущих відмінностей між групою прийому мінеральної води та групою плацебо (P = 0,571). Дванадцять із них відбулися у групі активного продукту, і ще чотири події відзначені у групі плацебо. Один випадок групи активного продукту може бути пов'язані з впливом. У двох випадках, що сталися у групі активного продукту, причинно-наслідковий зв'язок небажаного явища з впливом, можливий. Одне з небажаних явищ групи активного продукту було класифіковано, як серйозне, але з пов'язані з впливом.
Жоден з досліджуваних клінічних параметрів, у тому числі печінкові ферменти, тригліцериди, холестерин, Х-ЛПВЩ (холестерин ліпопротеїнів високої щільності), Х-ЛПНЩ (холестерин ліпопротеїнів низької щільності), артеріальний тиск та частота серцевих скорочень значення, не відрізнявся між групами .
Щодо використання резервних препаратів для полегшення симптомів щодо споживання таких препаратів відмінностей між групами не відзначено (P = 0,240).
Статистично значимих відмінностей між групами у відхиленні фактичного споживання досліджуваних препаратів від очікуваного споживання був (P>0,1). Показник ступеня прихильності до лікування з урахуванням споживання досліджуваного продукту становив 102% ± 8,6 у групі активного продукту та 105% ± 9,4 у групі плацебо.
Мал. 2. Консистенції стільця СВК/ВК з використанням Брістольської шкали стільця/форми калу (BSFS) (типи за шкалою BSFS, медіана, інтерквартильний діапазон, діапазон) протягом періоду впливу (сірий колір – група активного продукту, білий колір – група плацебо). Рахунок за Брістольською шкалою стільця/форми калу: від 1 (тверді грудки) до 7 (водянистий стілець). *P - значення P (U-критерій Манна-Уітні) для визначення відмінностей між групами дослідження.
Таблиця 4. Середнє значення (і SD) показника за шкалою оцінки вираженості симптомів з боку шлунково-кишкового (GSRS)
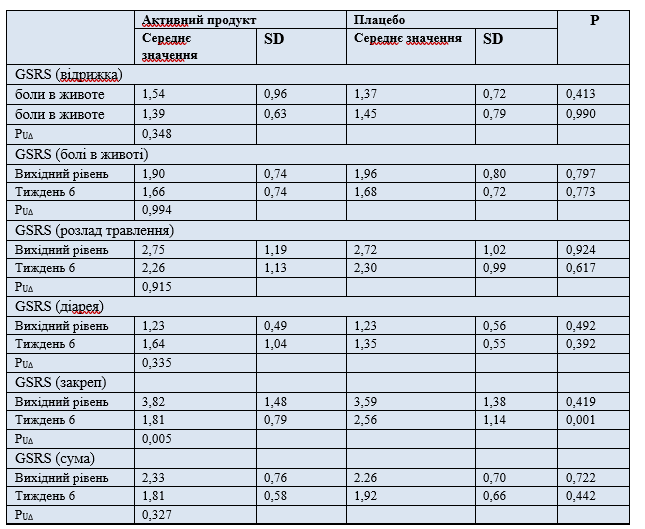
PUΔ - значення P (U-критерій Манна-Уітні) для визначення відмінностей між групами дослідження щодо зміни суми балів за шкалою SSRS між вихідним та кінцевим відвідуванням.
P – значення P (U-критерій Манна-Уітні) для визначення відмінностей між групами дослідження.
SD – стандартне відхилення.
Обговорення
У цьому рандомізованому, плацебо-контрольованому, подвійному сліпому, інтервенційному дослідженні у пацієнтів з функціональними закрепами отримані клінічні докази того, що прийом мінеральної води, багатої сульфатом магнію і сульфатом натрію протягом 6-тижневого курсу лікування може дати значні переваги для оздоровлення. Зменшення симптомів закрепу, як видно зі збільшення кількості ПСВК, загальної кількості випорожнень кишечника на тиждень і появи більш м'якого стільця в порівнянні з групою учасників, які приймали воду з низьким вмістом мінералів, що підтвердило попереднє припущення про стимулюючий вплив природної води, багатої на мінерали, на процес травлення. І справді, під час дослідження кількість ПСВКу на тиждень у групі, що приймали природну воду, багату на мінерали, збільшилася більш ніж утричі, що можна порівняти з дією подорожника і чорносливу, демонструючи збільшення середньої кількості ПСВК на тиждень більш ніж у два рази [24] . Одночасно з покращенням об'єктивних параметрів функції кишечника в учасників дослідження спостерігалося зменшення закрепів з оцінкою за шкалою GSRS з перевищенням показника мінімальної клінічно значущої зміни суми балів, що дорівнює 0,5 [25] разом із загальним покращенням якості життя, пов'язаного зі здоров'ям.
Зміна кількості ПСВКу на тиждень була обрана як первинна кінцева точка, оскільки це вважається найбільш чутливим параметром оцінки загальної функції кишечника, і, як інформація про повноту випорожнення кишечника [26]. Оскільки адекватного та добре контрольованого клінічного випробування досліджуваного продукту на момент планування даного дослідження не було, для коригування розміру вибірки було застосовано адаптивний дизайн дослідження. Це було зроблено також для того, щоб на ранньому етапі оцінити: необхідно припинити все клінічне дослідження або тільки його частину щодо груп прийому низької (300 мл) або прийому високої дози (500 мл), якщо ефективність первинної кінцевої точки відсутня або вже досягнута при проміжному аналізі. Якщо розглядати дані за показником ПСВК, то прийом 300 мл мінеральної води на день, мабуть, не дає переваг учасникам дослідження, і тому на підставі результатів проміжного аналізу подальше дослідження цієї групи було завершено, тоді як розмір вибірки груп прийому 500 мл було збільшено. Зважаючи на результати цього клінічного дослідження, споживання 500 мл на день мінеральної води «Донат магній», ефективніше, ніж прийом 300 мл, як для покращення показника ПСВКу, так і для спорожнення кишечника в цілому, та покращення консистенції випорожнень.
Оскільки, як пропонується, харчові звички та фактори способу життя впливають на функцію кишечника, було проведено оцінку харчових та питних звичок учасників дослідження та рівня фізичної активності. У результаті дослідження відзначено лише незначне збільшення споживання сухофруктів групи активного продукту проти групою плацебо. Враховуючи напівкількісний характер дієтичної оцінки та незначні відмінності, що спостерігаються, між групами дослідження, дуже малоймовірно, що ця зміна могла вплинути на результати дослідження.
Результати цього клінічного дослідження узгоджуються з результатами іншого нещодавно опублікованого дослідження, в якому порівнювали різні дози мінеральної води із плацебо.
У цьому дослідженні було показано, що щоденне вживання 1 л мінеральної води, багатої на сульфат магнію (магнію 119 мг/л, сульфатів 1530 мг/л), зменшує закреп і покращує консистенцію випорожнень у жінок з функціональними закрепами [13].
Хоча дослідницька група була обмежена жінками та первинною кінцевою точкою була відповідь на лікування, яку оцінювали за компонентами критеріїв Rome III, при цьому про кількість спорожнень кишечника не повідомлялося, це дослідження підтверджує позитивний ефект природної мінеральної води, багатої магнієм та сульфатами на функцію кишечника.
У цьому дослідженні вивчали вплив мінеральної води, що містить 13 г/л розчинених мінеральних речовин, серед них був сульфат магнію та сульфат натрію.
Магній сульфат має осмотичну дію, затримуючи воду в просвіті кишечника, що призводить до збільшення обсягу фекальної маси та її м'якшої консистенції, яка тисне на стінки кишечника, провокуючи перистальтику [27, 28].
Дослідження, проведене у здорових людей, показало, що високі дози сульфату магнію, що перорально вводиться, призводять до зменшення часу транзиту по кишечнику і модулюють антродуоденальну моторику при лікувальному голодуванні, але не в стані після прийому їжі [11].
Зовсім недавно, у дослідженнях in vivo та in vitro було показано, що поряд зі зміною осмотичного тиску, викликаного дією сульфату магнію, індукується експресія осморегуляторних генів [29, 30]. Крім того, було показано, що експресія аквапорин 3 гена, що бере участь у регуляції вмісту води у фекальних масах у товстій кишці, була збільшена в товстій кишці у щурів після введення магнію сульфату [30].
В іншому дослідженні у щурів повідомлялося про те, що проносна дія сульфату магнію може включати процес утворення оксиду азоту (NO) за допомогою стимуляції NO-синтази [31].
Відомо також, що сульфати збільшують об'єм фекальної маси та покращують консистенцію випорожнень; прийом води, що містить понад 1000 мг сульфату/л, пов'язували за даними самозвітів пацієнтів із послаблюючим ефектом [32, 33].
Вплив досліджуваної мінеральної води на частоту і консистенцію випорожнень, пов'язане з природним високим вмістом у ній магнію та сульфатів.
Слід зазначити деякі обмеження дослідження. На додаток до дії мінеральної води на запор, оцінювали її вплив на весь шлунково-кишковий тракт та загальну якість життя. Тим не менш, могло б бути більш доцільним для оцінки відповідних симптомів та якості життя використовувати опитувальник, розроблений спеціально для оцінки закрепів, а не загальніші опитувальники, які застосовувалися в цьому дослідженні. При цьому, після того, як 50% від запланованої кількості учасників були включені в дослідження, проведення дослідження групи прийому нижчої дози було зупинено на підставі рекомендації НКМД (Незалежний комітет з моніторингу даних). Тим не менш, можливо, що розмір вибірки був занадто малий, щоб зробити однозначний висновок щодо прийому групи 300 мл. Подальші клінічні дослідження з великим розміром вибірки могли б бути корисними вивчення впливу природної води, багатої мінералами. Крім того, визначення інших параметрів діяльності кишечника, що зумовлюють стан здоров'я, таких як фекальна маса, час транзиту або потенційний вплив на мікробіоти, сприятиме подальшому з'ясуванню механізму дії, що лежить в основі.
Таким чином, представлене дослідження, проведене у людей, які не мають інших захворювань, підтверджує позитивний ефект щоденного споживання 500 мл природної питної мінеральної води на функції кишечника у осіб з функціональним закрепом.
Крім того, було доведено безпеку та хорошу переносимість споживання цієї специфічної мінеральної води.

Це, у свою чергу, може допомогти зменшити шлунково-кишковий дискомфорт та розвиток захворювань, часто пов'язаних із запорами. І, нарешті, це може покращити пов'язану зі здоров'ям якість життя та згодом знизити економічний тягар на систему охорони здоров'я.
Список подяк від авторів. Ми хотіли б подякувати Норманові Біттерліху, доктору філософії. (Медицин & Сервіс, ГмбХ/ Medizin & Service GmbH) та Вернера Баурехта (акроміон, ГмбХ/ acromion GmbH) за їхню суттєву підтримку при проведенні статистичного аналізу даних.
Дотримання етичних норм. Конфлікт інтересів. Дослідження фінансувалося компанією Дрога Колінська, буд. (Любляна, Словенія). Альяз Кох був найнятий для роботи компанією Дрога Колінська, буд. Гордана Боте та Аннегрет Ауінгер були найняті для роботи контрактною дослідницькою організацією. Автори заявляють про відсутність будь-яких інших конкуруючих інтересів щодо цього дослідження.
Відкритий доступ. Ця стаття поширюється відповідно до умов ліцензії Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), що дозволяє її необмежене використання, розповсюдження та відтворення на будь-якому носії, за умови, якщо Ви довіряєте автору (авторам) оригінальної статті та джерела, дайте посилання на ліцензію Creative Commons License та вкажіть, чи були внесені зміни.
Список літератури:
- Dupont C, Campagne A, Constant F (2014) Efficacy and safety of a magnesium sulfate-rich natural mineral water for patients with functional constipation. Clin Gastroenterol Hepatol. doi:10.1016/j.cgh.2013.12.005
- Norton C (2006) Constipation in older patients: effects on quality of life. Br J Nurs. doi:10.12968/bjon.2006.15.4.20542
- Burkitt DP, Walker AR, Painter NS (1972) Effect of dietary fibre on stools and the transit-times, and its role in the causation of disease. Lancet 2(7792):1408–1412
- Sun SX, Dibonaventura M, Purayidathil FW, Wagner JS, Dabbous O, Mody R (2011) Impact of chronic constipation on health-related quality of life, work productivity, and healthcare resource use: an analysis of the National Health and Wellness Survey. Dig Dis Sci. doi:10.1007/s10620-011-1639-5
- Drossman DA (2006) The functional gastrointestinal disorders and the Rome III process. Gastroenterology. doi:10.1053/j.gastro.2006.03.008
- Schmidt FM, Santos VL (2014) Prevalence of constipation in the general adult population: an integrative review. J Wound Ostomy Cont Nurs. doi:10.1097/01.WON.0000438019.21229.b7
- Peppas G, Alexiou VG, Mourtzoukou E, Falagas ME (2008) Epidemiology of constipation in Europe and Oceania: a systematic review. BMC Gastroenterol. doi:10.1186/1471-230X-8-5
- Wyman JB, Heaton KW, Manning AP, Wicks AC (1978) Variability of colonic function in healthy subjects. Gut 19(2):146–150
- Wenzl HH, Fine KD, Schiller LR, Fordtran JS (1995) Determinants of decreased fecal consistency in patients with diarrhea. Gastroenterology 108(6):1729–1738
- Weaver LT (1988) Bowel habit from birth to old age. J Pediatr Gastroenterol Nutr 7(5):637–640
- Muller-Lissner S, Tack J, Feng Y, Schenck F, Specht Gryp R (2013) Levels of satisfaction with current chronic constipation treatment options in Europe—an internet survey. Aliment Pharmacol Ther. doi:10.1111/apt.12124
- Vu MK, Nouwens MA, Biemond I, Lamers CB, Masclee AA (2000) The osmotic laxative magnesium sulphate activates the ileal brake. Aliment Pharmacol Ther 14(5):587–595
- Stewart JJ, Gaginella TS, Olsen WA, Bass P (1975) Inhibitory actions of laxatives on motility and water and electrolyte transport in the gastrointestinal tract. J Pharmacol Exp Ther 192(2):458–4671
- Constant F, Morali A, Arnaud MJ, Delabroise AM, Thirion F, Matisse N, Wagner M, Dohm JP, Vuillemin JL, Gay G (1999) Treatment of idiopathic constipation in infants: comparative and randomized study of twa mineral waters (60 cases). J Pediatr Gastroenterol Nutr 28(5):551
- Gasbarrini G, Candelli M, Graziosetto RG, Coccheri S, Di Iorio F, Nappi G (2006) Evaluation of thermal water in patients with functional dyspepsia and irritable bowel syndrome accompanying constipation. World J Gastroenterol 12(16):2556–2562
- Drossman DA (2006) Rome III: the new criteria. Chin J Dig Dis. doi:10.1111/j.1443-9573.2006.00265.x
- Lewis SJ, Heaton KW (1997) Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol. doi:10.3109/00365529709011203
- Dimenas E, Glise H, Hallerback B, Hernqvist H, Svedlund J, Wiklund I (1995) Well-being and gastrointestinal symptoms among patients referred to endoscopy owing to suspected duodenal ulcer. Scand J Gastroenterol 30(11):1046–1052
- Ware J Jr, Kosinski M, Keller SD (1996) A 12-Item Short-Form Health Survey: construction of scales and preliminary tests of reliability and validity. Med Care 34(3):220–233
- Lee PH, Macfarlane DJ, Lam TH, Stewart SM (2011) Validity of the international physical activity questionnaire short form (IPAQ-SF): a systematic review. Int J Behav Nutr Phys Act. doi:10.1186/1479-5868-8-115
- Chow S-C, Chang M (2012) Adaptive design methods in clinical trials. Chapman & Hall/CRC, New York
- Lehmacher W, Wassmer G (1999) Adaptive sample size calculations in group sequential trials. Biometrics 55(4):1286–1290
- Chang M (2008) Adaptive design theory and implementation using SAS and R. Chapman & Hall/CRC, New York
- Attaluri A, Donahoe R, Valestin J, Brown K, Rao SS (2011) Randomised clinical trial: dried plums (prunes) vs. psyllium for constipation. Aliment Pharmacol Ther. doi:10.1111/j.1365-2036.2011.04594.x
- 25. Talley NJ, Fullerton S, Junghard O, Wiklund I (2001) Quality of life in patients with endoscopy-negative heartburn: reliability and sensitivity of disease-specific instruments. Am J Gastroenterol. doi:10.1111/j.1572-0241.2001.03932.x
- Mueller-Lissner S, Kamm MA, Wald A, Hinkel U, Koehler U, Richter E, Bubeck J (2010) Multicenter, 4-week, double-blind, Eur J Nutr (2017) 56:491–499 4991 randomized, placebo-controlled trial of sodium picosulfate in patients with chronic constipation. Am J Gastroenterol. doi:10.1038/ajg.2010.41
- Donowitz M (1979) Current concepts of laxative action: mechanisms by which laxatives increase stool water. J Clin Gastroenterol 1(1):77–84
- Izzo AA, Gaginella TS, Capasso F (1996) The osmotic and intrinsic mechanisms of the pharmacological laxative action of oral high doses of magnesium sulphate. Importance of the release of digestive polypeptides and nitric oxide. Magnes Res 9(2):133–138
- Ikarashi N, Mochiduki T, Takasaki A, Ushiki T, Baba K, Ishii M, Kudo T, Ito K, Toda T, Ochiai W, Sugiyama K (2011) A mechanism by which the osmotic laxative magnesium sulphate increases the intestinal aquaporin 3 expression in HT-29 cells. Life Sci. doi:10.1016/j.lfs.2010.11.013
- Ikarashi N, Ushiki T, Mochizuki T, Toda T, Kudo T, Baba K, Ishii M, Ito K, Ochiai W, Sugiyama K (2011) Effects of magnesium sulphate administration on aquaporin 3 in rat gastrointestinal tract. Biol Pharm Bull 34(2):238–242
- Izzo AA, Gaginella TS, Mascolo N, Capasso F (1994) Nitric oxide as a mediator of the laxative action of magnesium sulphate. Br J Pharmacol 113(1):228–232
- Moore EW (1952) Physiological effects of the consumption of saline drinking water. In: A progress report to the 16th meeting of the subcommittee on sanitary engineering and environment. Appendix B. National Academy of Sciences, Washington, DC
- Heizer WD, Sandler RS, Seal E Jr, Murray SC, Busby MG, Schliebe BG, Pusek SN (1997) Intestinal effects of sulfate in drinking water on normal human subjects. Dig Dis Sci 42(5):1055–1061



































